规范抗凝治疗中深静脉血栓复发,如何探寻病因?
患者丁XX,男,59岁,因双下肢不对成水肿3月,再发加重1月入院。
现病史:
3月余前(2017.2.10)患者无明显诱因出现右侧下肢水肿明显,伴右下肢小腿疼痛,就诊于当地医院,完善下肢血管超声后诊断为“右下肢深静脉血栓形成”,住院治疗(2.23-3.6),期间给予华法林3mg qd联合阿司匹林100mg qd口服治疗后患者牙龈出血,遂将“华法林”改为0.75mg qd口服,出院时右下肢水肿较前稍好转,仍有肿胀。出院后继续药物治疗,右下肢水肿逐渐消退。
1月余患者无明显诱因出现左侧下肢皮肤颜色紫绀,皮温及张力高,伴疼痛,再次就诊于当地医院,住院治疗(3.20-4.17),继续给予华法林0.75mg qd及阿司匹林100mg qd口服。症状未见好转。 2天前(5.13)患者左下肢水肿明显加重,活动后疼痛明显。于5.15入院。自起病以来,患者无胸痛、咯血、呼吸困难症状,否认长期卧床及长途旅行。
既往史:
8年前发现高血压,最高达180/110mmHg,未服用药物,近来监测血压正常。4月前因左手指紫绀,沿桡动脉处疼痛、水肿,当地行超声提示“左锁骨下动脉狭窄”,行介入支架植入1枚,术后予阿司匹林100mg qd、氯吡格雷75mg qd双联抗血小板聚集,服用1月后因开始华法林治疗而停用氯吡格雷。服用阿托伐他汀10mg qn调脂、稳定斑块治疗。
个人史:
吸烟40年,20-30支/天,已戒2月余。
家族史:
父亲体健,母亲10余年前发现“胃癌”,确诊后曾发生“肺栓塞”,3年前因胃癌去世。
入院查体:
T 36.5℃,P 84次/分,R 20次/分,Bp 131/80mmHg,身高:175cm,体重:78kg,BMI:25.5kg/m2。神清,全身浅表淋巴结未扪及肿大,胸廓对称无畸形,呼吸运动正常,双肺呼吸音清,未闻及干湿性啰音,心律齐,P2无亢进或分裂。腹部平软,无压痛或反跳痛,未扪及包块,肠鸣音正常。左侧下肢径前皮肤肿胀,双下肢膝关节以下凹陷性水肿,左侧较右侧小腿肿胀明显,张力高,皮温高,双侧足背动脉搏动稍减弱。测量腿围:髌骨上15cm左44.5cm,右41cm;髌骨下10cm 左47.5cm,右36.9cm。
辅助检查:
双下肢静脉超声(2017.3.24当地医院):1.右下肢深静脉、左侧腘静脉及胫后静脉血栓形成。2.右下肢浅静脉血栓形成。
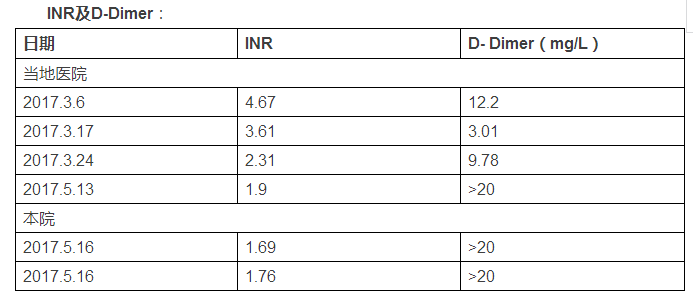
血常规(2017.5.15):HGB 110g/L ↓ ,PLT 128g/L
肝功能(2017.5.15):ALT 77IU/L ↑ 、AST 47IU/L ↑ 、TBIL23.73umol/L
蛋白C活性(2017.5.16):44% ↓(华法林使用中)
蛋白S活性(2017.5.16):65% (华法林使用中)
抗凝血酶III(2017.5.16):97%
CEA(2017.5.16): 29.54ng/ml ↑ ;(2017.5.23)33.53ng/ml ↑
胃泌素释放肽前(2017.5.16):64.16pg/ml ↑
IgM(2017.5.16):43.9mg/dl↓
ESR(2017.5.16)10mm/h
高敏C反应蛋白(2017.5.23):4.93mg/L↑
血管炎抗体谱、抗核抗体谱、类风湿关节炎抗体谱、甲状腺功能、前列腺抗原、血清铁蛋白无特殊
双侧下肢静脉超声(2017.5.16):双侧大隐静脉、股静脉、腘静脉内条状实性低回声,考虑静脉血栓。
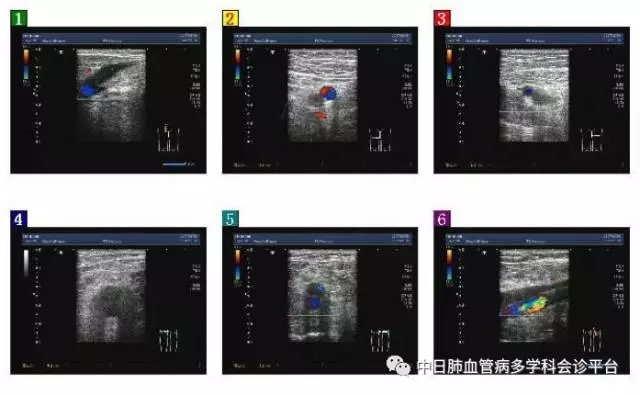
双下肢动脉超声(2017.5.16):双下肢动脉粥样硬化。
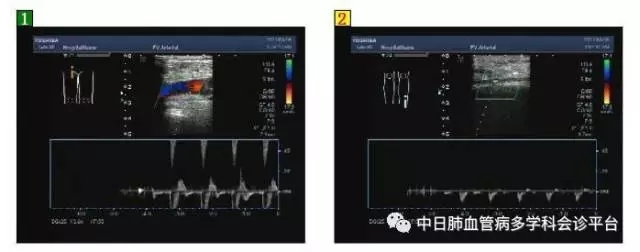
超声心动图(2017.5.16):心脏结构及功能未见异常。
腹部超声(2017.5.17):脂肪肝、胆囊结石。
泌尿系超声(2017.5.18):双肾缩小(右肾大小9.8*4.8cm,左肾大小8.7*4.2cm),前列腺增大伴钙化。
诊疗经过:
入院后完善患者血栓危险因素的筛查,患者血小板正常,有轻度贫血。应用华法林期间测定凝血八项蛋白C活性降低(44%),停用1周复查恢复至95%。抗心磷脂抗体阴性,抗β2糖蛋白抗体均阴性,肿瘤标记物示CEA明显升高。C反应蛋白升高。腹部超声未见占位性病变,双肾体积缩小。
考虑患者在华法林使用期间复发深静脉血栓,遂改为低分子肝素抗凝。根据患者体重(78kg),入院后给予低分子肝素0.8ml qd+0.6ml qn抗凝治疗。治疗1周后,患者左侧腿围缩小,肿胀、疼痛症状逐渐缓解。
下肢深静脉血栓复发的原因处理如下:
1. 结合患者动脉狭窄及下肢深静脉血栓形成病史,此次入院后发现肾脏缩小,不除外肾动脉狭窄可能,对患者全身大血管进行影像学方面评估。下腔静脉CTV(5.19)示未见明确血栓形成。胆囊结石。左肾动脉起始部轻度狭窄,左肾部分实质梗死。头颈CTA(5.23)示左锁骨下动脉支架植入术后,支架两端及管腔未见明确狭窄。由于患者缺乏发热、血沉增快等系统性受累表现,动脉管壁未见明显增厚毛糙的特征性改变,动脉炎特别是大动脉炎诊断依据不足。
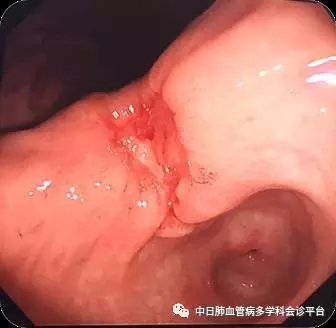
2. 患者CEA明显升高,不能除外恶性肿瘤。因此进行PET-CT检查(5.27)。结果回报:胃角部胃壁稍厚,葡萄糖代谢增高(SUVmax= 3.3),不除外恶性病变可能,胃左淋巴结稍大,葡萄糖代谢增高(SUVmax =1.8)。根据PET-CT结果提示行电子胃镜检查,于胃角处见一直径约2cm溃疡,周边皱襞中断。病理示腺癌,CK7(+),CEA(+),KP-1(-),CDX-2(+),Villin(+)。
修正诊断:
复发性双下肢深静脉血栓症
肿瘤相关性
胃腺癌
高血压3级极高危
左锁骨下动脉粥样硬化伴狭窄 (支架植入术后)
左肾动脉狭窄(轻度)
双肾萎缩
左肾上极梗死
后续治疗:
术前置入下腔静脉滤器,接受充分抗凝治疗直至术前12小时,在腹腔镜下行胃癌根治术及淋巴结清扫。术后12小时内恢复低分子肝素抗凝治疗,术后第10天取出下腔静脉滤器。出院后继续低分子肝素抗凝治疗至少3个月后复诊评价VTE风险。
诊断分析与讨论:
患者中年男性,在口服华法林维持INR达标情况下,下肢深静脉血栓(DVT)仍复发。DVT发生后可导致同侧下肢静脉瓣关闭障碍,加重血流瘀滞,因此抗凝治疗中可能出现同侧DVT加重及复发可能。但该患者为对侧DVT复发,则更为少见。利用下肢深静脉超声和下腔静脉CTV评价血栓负荷,并核实抗凝治疗依从性良好,需要进一步明确DVT复发后血栓负荷和导致DVT的原因,并制定合理的抗凝治疗方案。
DVT的致病机制分为遗传和获得性。该例患者虽有吸烟、轻度肥胖等DVT获得性危险因素,但Caprini模型等VTE风险评分系统中常见的高危因素证据不足。在诊断思路上,应首先除外凝血因子异常、蛋白S(PS)、蛋白C(PC)或抗凝血酶Ⅲ(ATⅢ)缺乏等遗传因素,继而积极完善相关检查排查恶性肿瘤、结缔组织病等继发因素。PS/PC缺乏症及ATⅢ缺乏是中国汉族VTE患者最为重要的遗传性因素,三种抗凝蛋白缺陷约占遗传性VTE的50%[1,2]。除临床症状外,诊断还要依赖血浆定量和功能检测,可单纯表现为活性降低,或蛋白浓度降低合并活性降低。目前已有针对汉族人群的参考值范围应用于临床,判断是否存在活性缺陷[3]。因华法林可导致PC及PS的谷氨酸残基无法进行羟化,停留在无活性阶段,故需停药5天以上方可检测PC及PS活性。当PC和PS活性分别为70%和55%以上者,可不考虑进一步基因检测[4]。
初步除外常见的抗凝蛋白缺陷后,需要进一步排查继发于结缔组织疾病或恶性肿瘤的易栓症。结缔组织疾病可能通过血小板、凝血及纤溶系统等环节导致血液高凝状态,或破坏血管内皮稳态,导致静脉血栓栓塞症(VTE)形成。其中系统性红斑狼疮、抗磷脂抗体综合征及系统性血管炎等均是较易继发VTE的结缔组织疾病,而糖皮质激素治疗可能进一步加重VTE风险[5-7]。在病史采集上,需详细询问有无多系统受累的表现;在查体上,需着重检查皮肤、关节、血管杂音等上述结缔组织疾病常累及的靶器官;在实验室检查上,除ANA、ANCA抗体谱及抗心磷脂抗体、狼疮抗凝物等特异性检查外,血小板数量、红细胞沉降率、C-反应蛋白、铁蛋白等反映机体炎性状态的指标亦需特别关注;在影像学检查方面,动脉CTA可能发现动脉狭窄、管壁增厚等大动脉炎特异性表现。该患者有左锁骨下动脉狭窄病史,入院后发现左肾动脉起始部轻度狭窄,左肾部分实质梗死,在接诊初期曾考虑大动脉炎诊断不能除外。但患者缺乏发热、血沉增快等系统性受累表现,动脉管壁未见明显增厚毛糙的特征性改变, PET-CT未见血管壁异常摄取灶,动脉炎特别是大动脉炎诊断依据不足。
VTE是恶性肿瘤患者的主要并发症,是导致死亡的原因之一。对患者进行了包括CEA、AFP、CA125、CA199多个肿瘤标志物在内的筛查,发现CEA呈现5倍以上异常升高,因此高度怀疑有潜在的恶性肿瘤病变,并表现为以下肢DVT为首发症状。消化道肿瘤特别是胃腺癌、胰腺癌及盆腔内肿瘤伴发DVT及PE的风险高于其他部位肿瘤[8]。但该患者缺乏肿瘤占位性病变伴发的疼痛、消瘦等常见症状,也缺乏触痛、包块等异常体征,腹盆腔超声、增强CT等影像学检查也未见异常占位。但CEA升高在恶性肿瘤诊断中特异性和灵敏度均较高,仍是早期诊断的良好生物标志物。为了积极寻找原发肿瘤灶,实现早期治疗提高生存期,并寻找VTE形成的高危因素,该患者完善了PET-CT检查,发现胃角部胃壁及胃左淋巴结葡萄糖代谢增高,继而完善胃镜检查,并钳夹组织明确病理诊断,之后接受腹腔镜手术治疗。
临床观察证实,跟踪观察特发性静脉血栓形成患者的肿瘤发生率远高于正常人群,也比继发性DVT患者更易发生恶性肿瘤,有10-25%的患者在诊断特发性静脉血栓形成后2年发现恶性肿瘤,其中75%以上的患者在1年内发现恶性肿瘤[9]。其发病机理主要是静脉壁损伤、血液高凝状态、肿瘤细胞分泌促凝物质、肿瘤局部压迫效应导致血液瘀滞等。回顾该患者家族史,其母亲亦有胃癌合并DVT病史,提示可能在其发病中有遗传易感性。
多个RCT研究证实,针对恶性肿瘤患者进行积极的抗凝治疗可以降低VTE发生,但能否降低VTE导致的肿瘤病死率,循证证据尚不充足,现有的小规模病例报道提示患者可能从中获益[10]。因此仍可推荐在肿瘤活动期或接受抗肿瘤治疗期间应持续应用抗凝治疗。研究证实低分子肝素比包括华法林之内的维生素K拮抗剂(VKA)更有效,安全性也更高[11],而新型口服抗凝药在肿瘤相关VTE的治疗中仍缺乏足够证据级别。因此,低分子肝素仍然是活动期肿瘤患者抗凝的一线治疗药物。在ACCP 10版指南中[12],推荐对于有VTE危险因素且初学风险较低的实体肿瘤患者,应用低分子肝素或低剂量普通肝素抗凝(2B级);下肢DVT合并恶性肿瘤患者,出血风险为低-中度,推荐长期抗凝治疗(1B级),建议应用LMWH,而不是VKA长期抗凝治疗,无法应用LMWH治疗的患者,建议使用VKA,而不是达比加群或利伐沙班等新型口服抗宁要进行长期治疗(2B级)。在疗程上,应选择终生抗凝治疗或肿瘤被完全清除。针对该例患者,我们采用可回收下腔静脉滤器防止DVT脱落,仅在术前12小时停用抗凝,腹腔镜术后12小时即恢复抗凝治疗,并建议维持抗凝3-6个月后,对肿瘤负荷、DVT及出血风险进行综合评估,决定是否继续抗凝治疗。
参考文献
1. Liu HW, Kwong YL, Bourke C, et al. Highincidence of thrombophilia detected in Chinese patients with venous thrombosis.Thromb Haemost. 1994;71(4):416-9.
2. Shen MC, Lin JS, Tsay W, et al. Highprevalence of antithrombin III, protein C and protein S deficiency, but nofactor V Leiden mutation in venous thrombophilic Chinese patients in Taiwan.Thromb Res. 1997;87(4):377-85.
3. 朱铁楠, 赵永强, 丁秋兰, 等. 汉族人群蛋白C、蛋白S和抗凝血酶活性水平及活性缺乏发生率的研究. 中华血液学杂志. 2012 , 33 (2) :127-130
4. Labrouche S, Reboul MP, Guérin V, et al.Protein C and protein S assessment in hospital laboratories: which strategy andwhat role for DNA sequencing? Blood Coagul Fibrinolysis. 2003; 14(6):531-538.
5. Reynaud Q, Lega JC, Mismetti P, et al. Riskof venous and arterial thrombosis according to type of antiphospholipidantibodies in adults without systemic lupus erythematosus: a systematic reviewand meta-analysis. Autoimmun Rev. 2014; 13(6):595-608.
6. Arnaud L, Mathian A, Ruffatti A, et al.Efficacy of aspirin for the primary prevention of thrombosis in patients withantiphospholipid antibodies: an international and collaborative meta-analysis.Autoimmun Rev. 2014 ;13(3):281-91. 7.
7. Weidner S, Hafezi-Rachti S, Rupprecht HD, etal. Thromboembolic events as a complication of antineutrophil cytoplasmicantibody-associated vasculitis. Arthritis Rheum. 2006;55(1):146–9.
8. Kahn SR, Lim W, Dunn AS, et al. Preventionof VTE in nonsurgical patients: Antithrombotic Therapy and Prevention ofThrombosis, 9th ed: American College of Chest Physicians Evidence-BasedClinical Practice Guidelines. Chest. 2012 ;141(2 Suppl):e195S-e226S.
9. Monreal M, Trujillo-Santos J. Screening foroccult cancer in patients with acute venous thromboembolism. Curr Opin PulmMed. 2007;13(5):368-71.
10. Lindsay R, Su EY, Gerard S, et al. Effect oftesting for cancer on cancer- and venous thromboembolism (VTE)-relatedmortality and morbidity in patients with unprovoked VTE. Cochrane Database ofSystematic Reviews. 2015, 3. No.: CD010837.
11. Agnes YY, Lee MD, Mark N, et al.Low-Molecular-Weight Heparin versus a Coumarin for the Prevention of RecurrentVenous Thromboembolism in Patients with Cancer. N Engl J Med. 2003; 349:146-153
12. Clive K, Elie AA, Joseph O, et al.Antithrombotic Therapy for VTE Disease CHEST Guideline and Expert Panel Report.Chest.2016;149(2), 315–352.


 京公网安备 11010502052362号
京公网安备 11010502052362号